上海硅酸盐所等在利用新型蛋白基纳米材料打破
氧化还原稳态对细胞正常存活至关重要。相较于正常细胞,肿瘤细胞内活性氧水平明显升高,其氧化还原稳态更易被打破,从而造成活性氧在细胞内的累积,进而引发细胞凋亡。因此,打破细胞氧化还原稳态的肿瘤治疗方式具有良好的有效性和特异性,具有广阔的发展前景。蛋白基纳米材料因其较好的生物相容性、富含官能团便于载药修饰等优点被广泛应用于肿瘤诊疗研究,具有临床潜力。
近日,中国科学院上海硅酸盐研究所研究员陈航榕团队(多孔与纳米功能材料课题组)在制备新型蛋白基纳米复合材料用于打破细胞氧化还原稳态,实现高效肿瘤治疗研究方面取得新进展。该团队利用生物相容性良好的白蛋白作为纳米载体,通过对功能组分的调控,实现了谷胱甘肽(GSH)消耗辅助增强的化疗/化学动力学联合治疗,在小鼠皮下瘤模型中实现了对肿瘤生长的有效抑制。相关研究成果以Breaking the redox homeostasis: An Albumin-based Multifunctional Nanoagent for GSH depletion-assisted Chemo-/chemodynamic Combination Therapy为题,发表在Advanced Functional Materials上。
GSH是细胞内主要的抗氧化剂,对于清除胞内ROS,维持细胞的氧化还原稳态具有重要作用。无机功能组分通过仿生矿化的方式原位生长到白蛋白分子中,随后通过酰胺键连接顺铂前药分子得到粒径为20~30nm,且分散性、稳定性较好的蛋白基载药纳米颗粒CMBP。其中的锰氧化物组分可氧化GSH,使其含量下降,减少GSH-Pt加合物的产生,有助于提高顺铂药物的化疗效果;顺铂药物可通过激活烟酰胺腺嘌呤二核苷酸磷酸(NADPH)氧化酶(NOX)促进H2O2的产生,高表达的H2O2结合弱酸性肿瘤微环境,促进了铜基组分的类芬顿反应,增强了肿瘤区域化学动力学疗效。GSH含量的下降以及.OH的生成有效下调了谷胱甘肽过氧化物酶(GPX-4)表达,进一步加剧了肿瘤细胞内氧化还原失衡,从而实现化疗和化学动力学的协同增效治疗效果。体内外研究结果表明,所合成的蛋白基复合纳米颗粒具有良好的生物相容性和生物安全性,未产生明显毒性或引发机体的免疫排斥反应等。该研究为制备新型蛋白基纳米材料和有效打破肿瘤细胞氧化还原平衡,实现精准高效的肿瘤治疗提供了有益的参考。
上海硅酸盐所2016级直博生梁凯程和复旦大学附属中山医院博士生孙海涛为论文的共同第一作者,陈航榕为论文通讯作者。研究工作得到国家自然科学基金、上海市基础研究重点项目等的支持。
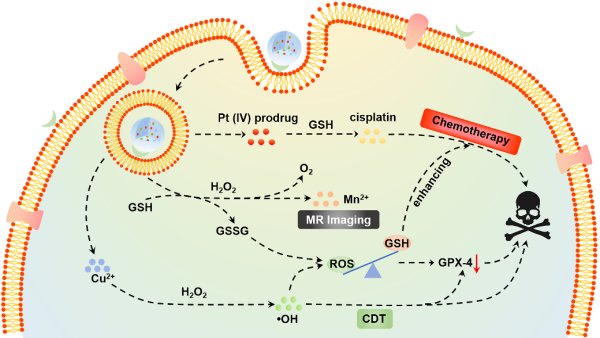
CMBP纳米颗粒打破肿瘤细胞内氧化还原平衡的作用机制示意图
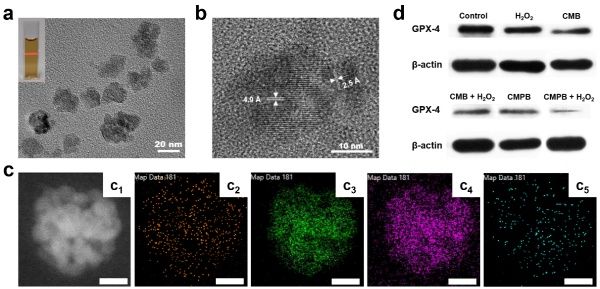
CMBP纳米颗粒的(a)TEM照片(插图为CMBP分散在水中的数码照片);(b)HRTEM照片;(c)(c1)CMBP的STEM图;(c2-c5)分别为Cu、Mn、O、Pt的元素面扫结果(标尺为10 nm);(d)不同条件下4T1细胞GPX-4酶的表达结果
【来源:上海硅酸盐研究所】
声明:转载此文是出于传递更多信息之目的。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 邮箱地?/p>
